
β-烟酰胺单核苷酸(NMN)作为抗衰老补充剂对健康中老年人(40-65岁)的有效性和安全性:一项随机、多中心、双盲、安慰剂对照、平行组、剂量依赖的人类临床试验
易林,理学硕士
Abinopharm, Inc.,美国康涅狄格州纽黑文市教堂街157号19楼,邮编06510
陶荣盛,理学硕士
湖州颐辉生物科技有限公司中国浙江省湖州市红丰路313000号
林志刚,博士
雅本化学股份有限公司中国上海市张江高科技园区李冰路67号4号楼,邮编:201203
Aditi Vaidya,理学硕士
ProRelix Services LLP, 102 A/B, Park Plaza, Karve Road, Karve Nagar, Pune, Maharashtra 411052, India
Sohal Pendse,理学学士
ProRelix Services LLP, 102 A/B, Park Plaza, Karve Road, Karve Nagar, Pune, Maharashtra 411052, India
Sornaraja Thasma,博士
ProRelix Services LLP, 102 A/B, Park Plaza, Karve Road, Karve Nagar, Pune, Maharashtra 411052, India
Niranjan Andhalkar, 博士
ProRelix Services LLP, 102 A/B, Park Plaza, Karve Road, Karve Nagar, Pune, Maharashtra 411052, India
Ganesh Avhad,医学博士
Lotus Healthcare & Aesthetics Clinic, 5 Bramha Chambers, 2010 Sadashivpeth, Tilak Road, Pune 411030, India
Vidyadhar Kumbhar, 医学博士
Sunad Ayurved, Siddhivinayak Apart, Jeevan Nagar, Chinwad, Pune 411033, India
通信至:
易林先生
Abinopharm, Inc.
美国康涅狄格州纽黑文市教堂街157号19楼,邮编06510
电话:908-392-7780
摘要
背景据广泛报道,哺乳动物细胞内NAD水平在衰老过程中显著下降,这对衰老相关的健康问题具有深远的影响。在许多动物研究中,补充β-烟酰胺单核苷酸(NMN)作为增强细胞内NAD的前体被证明是非常有效和安全的。然而,只有有限数量的人类临床试验在NMN上进行。仍然缺乏系统的人体临床研究来确定NMN对健康的影响和安全性的最佳剂量。此外,已发表的关于NMN的人类临床试验未能给出明确的结论,即NMN确实有效地增加了健康成人的人类血液细胞NAD浓度。到目前为止,还没有人类临床研究评估NMN对健康老年人的一般健康状况和生物学年龄的影响。
方法这项随机、多中心、双盲、安慰剂对照、平行分组、剂量依赖的人类临床试验在印度浦那的两个临床中心进行。筛选了84名健康的中老年男性和女性(40-65岁)。招募80名受试者,按照1:1:1:1的比例进行随机分层,进行为期60天的临床研究,每天口服一次安慰剂、300毫克NMN、600毫克NMN和900毫克NMN,由临床中心的主要研究人员进行分配和监测。所有的人口统计变量在四个组中平均分布。主要研究人员和试验参与者对研究用NMN产品和安慰剂均不知情。主要目的是通过在基线(第0天)、中点(第30天)和研究结束(第60天)测量血清中总血细胞NAD (NAD+ + NADH)浓度、六分钟步行耐力试验和SF-36问卷,评估NMN剂量递增方案在老年人和健康成人中的抗衰老效果。生物年龄(基于衰老。在基线(第0天)和研究结束(第60天)时,Insilco Medicine开发的具有19个临床血液实验室测试参数的Ai3.0计算器和用于胰岛素敏感性测量的HOMA-IR指数也被评估为探索性疗效研究。次要目的是通过体检、监测和记录不良事件,以及评估每个参与者在基线(第0天)和研究结束(第60天)时临床样本的实验室检测结果,研究NMN补充剂的安全性和耐受性。该试验已在ClinicalTrials.gov临床试验注册中心(NCT04823260,CTRI/2021/03/032421)注册,并已完成。
调查结果80名年龄在40-65岁之间的健康中老年人被招募到这项研究中。第一位参与者于2021年5月25日筛选,研究于2021年9月9日结束。所有80名参与者都完成了研究,没有违反研究方案。与安慰剂相比,在第30天和第60天,发现所有NMN治疗组(300毫克、600毫克和900毫克)的血液细胞内NAD水平在统计学上显著增加。与600毫克组和300毫克组相比,血清中的血细胞NAD水平也有统计学上显著的升高,但是从600毫克组到900毫克组没有统计学上显著的升高。在六分钟步行耐力测试中,六分钟内走过的距离也观察到了类似的结果。对于评估整体健康状况的SF-36问卷,所有三个治疗组(300毫克、600毫克和900毫克)在第30天和第60天的SF-36评分在统计上显著优于安慰剂组的评分,除了300毫克组在第30天的SF-36评分。然而,当在治疗组之间进行比较时,只有900毫克的SF-36分数在统计学上优于600毫克的分数。对于生物学年龄,当与安慰剂组相比时,在第90天时,发现所有治疗组(300毫克、600毫克和900毫克)在统计学上显著改善。最后,当分析胰岛素敏感性指标HOMA-IR指数时,在第60天,所有NMN治疗组(300毫克、600毫克和900毫克)与安慰剂相比没有统计学显著差异。至于安全性和耐受性,共观察到9例不良事件。这九个病例中没有一个被发现与NMN治疗有关。与基线或安慰剂相比,与第60天的结果相比,受试者的血液和尿液样本的临床实验室检测结果均未显示统计学上显著的异常变化。研究调查人员对所有参与者进行的体检发现,第60天与基线相比没有恶化。
解释这项研究证实,NMN补充剂以剂量反应和统计显著的方式增加了健康中老年(40-65岁)成人的血液细胞内NAD水平,并改善了体力和健康状况。我们首次揭示了NMN补充剂可以对人类生物学年龄产生积极影响。该研究得出结论,每日口服600毫克是最佳剂量,因为与600毫克相比,900毫克并没有对细胞NAD水平和六分钟步行距离产生静态显著改善。最后,NMN补充剂是安全的,并且在每天一次口服给药方案中高达900毫克的耐受性良好。
资金来源雅本化学有限公司, Abinopharm, Inc.
版权©2022作者。
简介
衰老一直被认为是一个自然过程。衰老过程中的许多健康状况,如皱纹、白发、身体退化(虚弱)等,一般被认为是正常的,而许多健康症状大多发生在衰老过程中,如癌症、糖尿病、心血管疾病、老年痴呆症等,被归类为疾病。最近,一些学者提出了这样一种观点,即衰老本身是一种疾病,可以通过某些干预措施来治疗。1,2衰老研究领域通常被称为老年学,主要涵盖两个领域:寿命和健康寿命。3寿命侧重于预期寿命或一个人能活多久。自从人类文明开始以来,人类从未停止过寻找长生不老的方法。然而,直到最近,科学家才发现老化干预可以延长活生物体和动物的寿命。例如,在研究实验室中,科学家报告说,他们可以将C. elegans的寿命延长10倍以上,4将小鼠的寿命延长1.9倍。5对人类寿命的研究更加复杂。“生物年龄”概念的提出是为了方便和准确地测量人类个体的健康状况。然而,目前还没有测量生物年龄的标准方法。取而代之的是一长串基于分子(DNA、RNA等)的不同生物年龄测试方法。)和衰老的表型生物标记(血液测试的临床测量)由不同的实验室或研究所提出。6健康寿命被定义为在健康状态下度过的一段时间,在衰老过程中没有慢性病和残疾。7一般来说,对健康寿命的研究涉及到这样的问题:人们在衰老过程中能否健康快乐地生活,以及人们能否预防与衰老相关的疾病的发生?改善健康寿命的预防性保健发现领域对人们的生活和社会经济有着巨大的影响,并引起了保健和生物制药行业的关注。8几个研究实验室最近发表的文章揭示了一个关于衰老干预的更引人注目的想法的结果:逆转衰老。9,10衰老的生物学机制现在比过去清楚得多。在2013年的一篇综述论文中,11 Serrano等人将衰老定义为细胞损伤随时间累积的结果,并将对寿命影响最大的生物因素概括为“衰老的九个特征”:基因组不稳定性、端粒磨损、表观遗传改变、蛋白沉积缺失、营养感应失调、线粒体功能障碍、细胞衰老、干细胞衰竭和细胞间通讯改变。
烟酰胺腺嘌呤二核苷酸NAD+是最丰富的分子之一,参与人体内500多种重要的生物反应,细胞内浓度随年龄的下降被认为是引起年龄相关健康问题的最重要因素之一。12它在所有上述“衰老的九个特征”中起着关键作用。13–15NAD+对衰老的生物学机制主要是通过其能量代谢功能和激活哺乳动物细胞中的PARP和Sirtuin蛋白。12近年来,NMN作为恢复NAD+水平的潜在营养补充剂引起了极大的关注。16世界各地的实验室发表了大量关于NMN的研究论文,内容涉及其在寿命和健康寿命中的作用以及其潜在的生物学机制。16–17
NMN是一种天然产物,少量存在于许多植物中,如卷心菜、花椰菜、蘑菇等。18它也是一种能在所有哺乳动物组织中发现的内源性分子。12迄今为止,在关于NMN发表的数千篇研究论文中,几乎所有这些论文都指出,其所有的生物学功能都可以追溯到NAD+,这是细胞NAD+生物合成中补救途径的产物,其中NMN充当前体。12,16,17在哺乳动物细胞中,通过烟酰胺核苷激酶(NRK1/2)的催化作用,来自饮食和饮食补充物或哺乳动物体内内源性产生的NMN可以高效地一步转化为NAD+。12NAD+水平在衰老过程中急剧下降。12,15衰老时NAD+水平下降有几个原因:由于NAMPT水平下降导致NAD+生物合成受损,NAMPT是一种催化NMN的细胞生物合成并控制NAD+生物合成的补救途径速度的酶,以及衰老期间CD38、PARPS和Sirtuins对NAD+的消耗增加。12,15NMN补充剂现在被广泛认为是恢复NAD+水平的高效方法。16,17
NMN,作为NAD+的前体,在许多对动物,特别是对衰老小鼠的临床前研究中显示出对各种衰老相关健康状况的益处。12,16,17例如,补充NMN减轻了小鼠年龄相关的生理衰退,18改善了老年小鼠的认知功能,19使老年小鼠的跑步耐力加倍,20有助于老年小鼠的骨形成,21逆转了老年小鼠的血管功能障碍,22在小鼠模型中在类似于干眼症的条件下对高渗应激下的眼细胞具有显著的保护作用,23改善了小鼠的抑郁,24最后限制了小鼠饮酒引起的肝损伤。25然而,这些结果能转移到人类身上吗?到目前为止,只有有限数量的NMN人体临床试验。12,16,17,26
NMN的第一次人体临床试验于2016年在日本进行。27,28这是一项对10名年龄在40-60岁之间的健康日本男性进行的开放性临床试验,在约60天的时间里,每日口服100毫克、250毫克和500毫克NMN。结果显示所有剂量都是安全的,耐受性良好。但是他们没有测量参与者血液样本中的NAD+水平。也没有观察到眼科益处和睡眠质量改善。第二次发表的NMN人体临床试验是由圣路易斯华盛顿大学医学院赞助的。29这是首次对NMN进行随机、双盲、安慰剂对照的人体临床试验。该研究招募了25名年龄在55-75岁之间的肥胖和糖尿病前期女性,每天固定口服250毫克NMN,持续10周。该试验证实,补充NMN显著增加了外周血单核细胞(PBMC)中的NAD+水平,但是骨骼肌中的NAD+变化不显著,并且在该研究中没有报道全血中的NAD+浓度。这项研究最重要的发现是NMN改善了糖尿病前期人群的骨骼肌胰岛素敏感性和胰岛素信号传导。没有观察到安全问题。这项研究只是对糖尿病前期女性群体的固定剂量。很难将许多研究结果推广到一般的老龄人口。关于NMN的第三次人体临床试验于2021年7月在《国际运动营养学杂志》上发表。30该研究调查了运动训练和NMN补充剂相结合对健康业余跑步者心血管健康的影响。该研究招募了48名健康人(年龄27-50岁,40名男性和8名女性),进行了为期六周的双盲、随机、安慰剂对照和四臂临床试验,每日口服300毫克、600毫克和1200毫克NMN。这项研究的主要结果是,与单独运动相比,运动补充NMN可以以剂量依赖的方式进一步增加健康业余跑步者的有氧能力,这可能是由于骨骼肌组织中氧利用率的增加。研究人员得出结论,NMN作为一种辅助治疗可能有助于提高运动员的成绩,在所有剂量下都没有观察到安全问题。这项研究的重点是NMN对运动员成绩的影响,没有测量NAD+水平。东京大学的研究人员和他们的合作者报道了第四个公开的NMN人体临床试验。T他们的草稿目前只在网上提供,没有任何同行评议。31这项研究招募了65名65岁以上的健康日本男性志愿者,口服固定剂量的250毫克NMN 12周。该研究首次证实,NMN补充剂确实可以显著提高健康老年男性的全血NAD+水平。在NMN治疗组中也观察到肌肉力量的增加。该研究发现,每天250毫克的NMN有很好的耐受性。这项研究的缺点是他们只对老年男性进行固定剂量的试验,有22名参与者在试验中途退出。很难将结果推断到老年女性身上。由于大量的退出,试验结果的可靠性受到影响。筑波大学的研究人员刚刚公布了NMN的第五次人体临床试验。32这是一项随机、双盲、安慰剂对照、平行分组的单中心研究,共有108名65岁以上的健康日本男性和女性参与者参加。参与者被均匀地随机分成4组,上午治疗组、上午安慰剂组、下午治疗组和下午安慰剂组。每个参与者在给定时间每天口服一次250毫克NMN或安慰剂。该研究的目的是调查老年人随时间摄入NMN对睡眠质量、疲劳和身体表现的影响。该研究仅发现,在下午治疗组中,嗜睡和5次坐起(5-STS)有统计学上的显著改善。该研究得出结论,在下午摄入NMN可以有效改善老年人的下肢功能和减少困倦,从而进一步有益于他们的身心健康,但该研究中测量的其他终点不是决定性的,并且没有测量NAD+水平。第六个也是最近一个关于NMN的人体临床试验由Metro International Biotech发表。33这是一项随机、双盲、安慰剂对照研究,对象为32名55-80岁的超重或肥胖成年男女。参与者服用1000毫克NMN的独特微晶多晶型物MIB-626,每天一次,每天两次,或服用安慰剂,共14天。主要目标是评估药代动力学和药效学。该研究揭示了血液NMN和NAD+水平的剂量依赖性和统计学显著增加。血液NMN或NAD水平的变化与性别、身体质量指数和年龄无关。此外,研究发现1000毫克每天一次或每天两次的方案是安全的。MIB-626目前正处于IIa期试验,用于治疗弗里德里克共济失调,这是一种罕见的遗传性变性神经系统疾病,症状包括行走困难、疲劳、感觉丧失等。这种疾病没有有效的治疗方法。
展望未来,仍然需要进一步的临床研究来系统地评估NMN补充剂在治疗和预防衰老相关的健康问题以及延长人们的健康寿命和寿命方面的作用。
在这里,我们想报告我们自己的人体临床试验。我们进行了一项多中心、随机、平行、双盲、安慰剂对照、剂量依赖性和四组临床试验,对80名年龄在40-65岁的健康男性和女性受试者使用我们的AbinoNutraTMNMN进行NMN补充,每日递增口服剂量300毫克、600ng和900毫克 NMN。我们的超纯AbinoNutraTMNMN是在GMP工厂采用专有的酶制造工艺生产的雅本化学股份有限公司总部位于中国上海。
背景研究 | |
本研究之前的证据 我们搜索了公共医学和谷歌学术。搜索词是“NAD”、“NMN”、“β-烟酰胺单核苷酸”、“抗衰老”、“长寿”和“临床试验”。搜索仅限于英文出版物,但对出版日期没有限制。通过体外和体内研究,已经对与年龄相关的细胞内NAD减少对健康问题的影响进行了大量的研究。许多动物研究表明,NMN可以安全地提高细胞内NAD浓度,改善衰老动物的健康状况。看看这些从动物身上得到的结果是否能应用到人类身上将会非常有趣。然而,到目前为止,我们只发现有六项关于NMN的人体临床试验被发表。报道的结果表明,NMN可以提高人体NAD水平,并在一定程度上改善与年龄相关的健康状况。但是这些研究大多集中在特殊的参与者群体,或特定类型的健康益处,或固定剂量。 | 这项研究的附加价值 这项研究是第一个关于补充NMN的人类临床试验,它清楚地表明,在300毫克、600毫克和900毫克(每天早餐前口服一次)的所有三种剂量下,血液细胞内NAD水平以剂量依赖性方式显著增加,600毫克是健康成年男女达到最高NAD+水平所需的最高每日口服剂量。这项研究也首次揭示,在60天的试验后,与安慰剂相比,所有三个剂量的NMN在生物学年龄方面都有统计学上的显著改善。此外,这项试验证实了与年龄相关的好处,如体力方面更好的六分钟步行距离和健康福祉方面更高的SF-36问卷得分。最后,该研究表明NMN对高达900毫克的单次每日口服剂量具有良好的耐受性。 |
所有可用证据的含义 NMN可剂量依赖性地有效增加人细胞内NAD水平,且口服日剂量高达2000毫克时耐受性良好。NMN可以是一种很好的营养补充剂,以维持人类在衰老过程中的福祉,并防止某些与年龄相关的健康问题。NMN还可以作为某些年龄相关疾病或遗传疾病的潜在治疗药物。 | |
方法
研究设计和参与者
这项研究在两个临床中心进行:莲花医疗美容诊所和Sunad Ayurved。两次都是在印度的浦那。该研究由ProRelix服务公司监测,该公司是一家临床研究机构(CRO),也位于印度浦那。
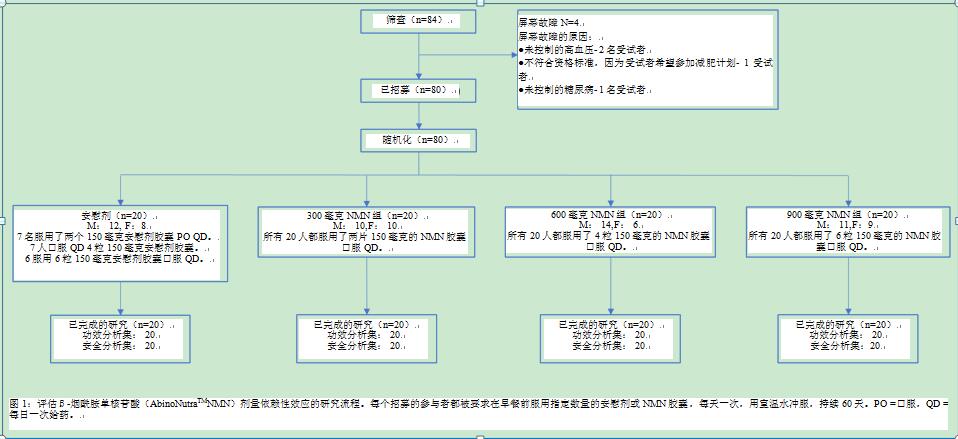
该试验包括年龄在40-65岁之间的健康男女参与者。通常,40岁以后,随着身体和精神的继续老化,人体内的新陈代谢随着各种生理功能的下降而减慢。与此同时,在60-65岁之间,可以看到不同性别之间的大量衰老变异。此外,迄今为止发表的临床试验大多招募健康状况或单一性别的参与者。因此,为了评估NMN的抗衰老作用,包括40 - 65岁的男性和女性的研究人群。纳入标准还包括体重指数(身体质量指数)在18.5和35 kg/m2之间,愿意提供书面知情同意书,愿意遵循口头和书面研究指导,在基线前7天和研究期间不服用任何含有任何形式烟酸的补充剂,能够在整个研究期间保持一致的饮食和生活习惯,愿意在治疗期间同意使用有效的避孕方法,并愿意服用指定的补充剂(NMN或安慰剂)2个月。纳入排除标准是为了防止不合适的参与者进入研究,例如那些身体状况可能会干扰研究结果的参与者。这些排除标准包括目前使用处方药或非处方药烟酸药物或补充剂,使用他汀类药物,在过去6个月中使用过任何烟草产品或娱乐性药物,具有异常的筛选实验室测试结果,这将排除研究者对研究的参与,具有动脉粥样硬化疾病和/或心肺疾病的记录,具有药物和酒精滥用史,在过去6个月中具有不稳定抑郁症或精神疾病史,这可能影响参与者遵守研究要求的能力,不愿意在研究前至少两周停止使用常规复合维生素/矿物质或其他补充剂,在研究期间参与或计划开始减肥饮食,生活方式或时间表与研究方案不相容,已知对研究期间使用的药物成分过敏,潜在女性参与者的尿β人绒毛膜促性腺激素或妊娠期或母乳喂养测试结果呈阳性,经研究者评估有新冠肺炎症状,患有其他会直接干扰研究结果或危害参与者健康的疾病或药物,目前或在过去30天内参与了不同的临床研究,无法提供静脉血样本,无法或不愿意提供参与研究的书面知情同意书。根据这些标准对84名参与者进行了筛选,其中80名符合条件并参与了研究(图1)。
该研究是根据赫尔辛基宣言(台北2016年)、ICH良好临床实践指南(1997年)以及新药和临床试验规则(2019年)规定的伦理原则进行的。在研究开始前,“印度浦那皇家伦理委员会”已经审查并批准了临床研究方案和知情同意书。只有在伦理委员会批准后,研究相关活动才开始进行。“浦那皇家伦理委员会”是根据“2019年新药和临床试验规则”成立的独立伦理委员会。伦理委员会已在印度(DCGI)药物总监处正式注册,注册号码为ECIV45/Indt/MII/2013/RR-19。
随机化和掩蔽
CRO公司ProRelix 服务以1:1:1:1的比例将80名参与者随机分为4组(20+20+20+20),一个安慰剂组和三个NMN剂量递增的三个治疗组,并考虑了所有人口统计学变量的均匀分布(表1)。随机名单被数字锁定在CRO的数据库中,保存在密封的信封里。
表1.80名参加AbinoNutraTMNMN临床试验的受试者的基线特征 | ||||
安慰剂,n = 20 | 300毫克NMN,n = 20 | 600毫克NMN,n = 20 | 900毫克NMN,n = 20 | |
年龄,平均值±标准差(年) | 46.50 ± 6.72 | 51.15 ± 6.99 | 49.45 ± 6.73 | 49.90 ± 6.32 |
性别,n (%) | ||||
男性 | 12 (60.0) | 10 (50.0) | 14 (70.0) | 11 (55.0) |
女性 | 8 (40.0) | 10 (50.0) | 6 (30.0) | 9 (45.0) |
种族,n(%) | 印度人,20 (100.0) | 印度人,20 (100.0) | 印度人,20 (100.0) | 印度人,20 (100.0) |
重量,平均值±标准差(千克) | 66.15 ± 13.51 | 69.22 ± 13.21 | 66.36 ± 10.51 | 66.77 ± 9.75 |
高度,平均值±标准差(厘米) | 156.70 ± 8.15 | 158.95 ± 9.99 | 156.55 ± 9.67 | 157.30 ± 8.15 |
BMI,平均值±标准差(千克/平方米) | 26.91 ± 4.91 | 27.36 ± 4.47 | 27.11 ± 3.90 | 26.93 ± 4.93 |
在整个试验过程中,研究者和参与者都不知道治疗分配,直到数据库解冻。参与者被分配到一个特定的试剂盒编号,而不知道它是安慰剂还是积极治疗。CRO随机分配该工具包。处理试剂盒分配的人也是盲的,不知道试剂盒是来自活性组还是安慰剂组。试验产品被放在不透明的瓶子里,以掩盖活性药物和安慰剂之间的任何差异。所有的瓶子标签都标明瓶子里装的是“NMN或安慰剂”。由于标签上同时提到了两种治疗方法,因此无论是参与者还是研究人员都无法知道两种方法中的哪一种(NMN/安慰剂)存在于瓶子中,从而保护了盲人。
随机列表提供给了两个临床试验中心。如果研究人员需要打开盲板(仅在严重不良事件或其他紧急情况下需要打开盲板)。他/她将呼叫CRO来解锁相关的参与者。在试验过程中,不需要打开遮片,并且在试验完成后,所有信封都保存完好,密封完好
程序
研究药物为食品级NMN膨松粉,品牌名称为AbinoNutra™NMN,由以下公司开发和生产雅本化学股份有限公司总部位于中国上海,与以下公司合作Abinopharm, Inc.位于美国康涅狄格州。为了研究期间的给药方便,中国南京的Polifarma将NMN散装粉末包装成含有150毫克 NMN/胶囊的胶囊。Polifarma还生产了安慰剂胶囊,其品牌、大小、形状和颜色与米粉相同。NMN胶囊和安慰剂胶囊都被运送到印度浦那的CRO ProRelix工厂。CRO通过将NMN胶囊和安慰剂胶囊包装成编码试剂盒来进行盲法试验。
基于之前对NMN的临床前和临床研究,12,17,27—32该研究设计了300毫克、600毫克和900毫克NMN的三种递增剂量方案。为了准确反映补充剂的最终用途,从而证明安全性/有效性,每天早餐前用室温水口服一次胶囊。研究周期设计为60天(图1)。根据之前记录的人类使用这种类型的补充剂的情况,预计这种频率是安全且耐受性良好的。
参与者被要求参观诊所中心四次。第一次访问是为了筛选资格;基线/随机化的第二次就诊(第0天);第三次就诊(第30天)进行中点疗效、安全性和依从性评估;第四次访视(第60天)进行研究结束时的疗效、安全性和依从性评估。这些访问的详细活动可以在补充材料的研究流程图和活动时间表部分看到。
80名参与者被平均分成300毫克NMN组、600毫克NMN组、900毫克NMN组和安慰剂组(20 + 20 + 20 + 20)。然而,预计存在一个与保持失明相关的操作问题。由于不同治疗组的研究药物是相同的150 毫克胶囊(NMN/安慰剂),因此需要服用不同数量的胶囊。那些被分配到300毫克NMN的人将不得不服用2粒胶囊,那些被分配到600毫克NMN的人将不得不服用4粒胶囊,那些被分配到900毫克NMN的人将服用6粒胶囊。为了保护试验中计划的双盲,在安慰剂组中设立了3个亚组。在安慰剂组中,7名参与者被要求服用2粒胶囊,另外7名被要求服用4粒胶囊,6名被要求服用6粒胶囊,以与治疗组相匹配(图1)。
受试者可能因以下任何原因随时退出研究:受试者撤回知情同意书、受试者不遵守给药方案(75%-125%不遵守)、出现需要退出研究的不良事件,以及根据研究调查人员的说法需要终止受试者参与研究的任何其他原因。在病例报告表(CRF)中记录了参与者退出临床试验的原因,以及所做的任何转诊。
所有80名参与者在没有违反研究方案的情况下完成了研究,并被纳入最终研究数据分析(图1)。
结果
为了证明每日口服300毫克、600毫克和900毫克的NMN持续60天的抗衰老作用,在基线、第30天和研究结束(第60天)时,将血清中的总细胞血液NAD水平作为生物标志物、用于测量体力的6分钟步行试验(6WMT)和用于健康幸福指标的36项简式调查(SF-36)问卷作为主要目标进行分析。胰岛素抵抗的稳态模型评估(HOMA-IR)和通过老化ai 3.0计算器的生物学年龄被评估为次要疗效终点。
血清中的血液细胞内NAD浓度:来自MyBiosource公司的比色NAD测试试剂盒(目录号MBS841786)用于测量参与者血液样品中的NAD浓度。比色NAD试验是一种测定血液、尿液或组织中细胞内NAD水平的有效方法。NAD以NAD+(氧化)、NADH(还原)、NADP+和NADPH形式存在。该测试测量血清中NAD+和NADH的总细胞内浓度,但不测量NADP和NADPH。当参与者访问试验中心时,在第0、30和60天采集每个参与者的血样。样本在临床实验室进行分析。首先使用NAD+/NADH提取缓冲液从血清样品中提取NAD+和NADH。提取物中的NAD+然后被醇脱氢酶转化为NADH。新形成的NADH和最初存在于样品中的NADH与NADH显色剂完全反应,形成高度着色的溶液。在OD 450nm处读取结果溶液。根据OD 450nm读数对照NADH标准曲线计算参与者’血清样品中的总细胞内NAD浓度。
六分钟步行耐力测试:6分钟步行试验(6MWT)是根据美国胸科协会34发布的测量耐力或体力的协议进行的。当参与者参观试验中心时,在第0、30和60天进行6分钟步行试验。在6分钟的行走测试中,参与者被要求在速度和/或坡度无法调节的跑步机上行走。以米为单位的距离通过跑步机的数字里程表记录。
SF-36问卷:SF-36代表36项简短形式的调查。SF-36问卷是由兰德公司开发的,被世界各地的临床医生用于评估个人或群体的健康或“生活质量”。35所有参与者在第0天、第30天和第60天参观试验中心时都接受了SF-36问题的测试。他们的回答由主要研究者在每次访问中收集。根据参与者的反应和SF-36评分指南计算每个参与者的总SF-36评分。
生物年龄:衰老。Ai 3.0计算器用于生物学年龄研究。它是由Insilico Medicine公司基于深度学习开发的。36我们得到了Insilico Medicine的许可,将他们的Aging.Ai 3.0用于我们的研究。通过以下步骤,基于在第0天和第60天收集的每个参与者样品的实验室测试参数,计算每个参与者在研究开始时(第0天)和研究结束时(第60天)的生物学年龄:第一步:收集每位参与者临床样本的19项临床实验室检测结果:白蛋白、葡萄糖(空腹)、尿素(BUN)、胆固醇、总蛋白、钠、肌酸、血红蛋白、总胆红素、甘油三酯、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇(Friedewald)、钙、钾、红细胞生成素、MCHC、MCV、血小板、红细胞(RBC)。第二步:每个参与者的生物年龄是通过http://aging.ai/#form_inp链接计算出来的。第三步:将19个实验室测试结果添加到在线计算器中。样本指标被选为“美国”。种族被选为“东亚”。每个参与者的体重(公斤)、身高(厘米)和吸烟史都被加了进去。第四步:在网上输入所有必要的值并点击“提交”后,参与者的生物年龄被获得。
HOMA红外指数:为了研究NMN对胰岛素抵抗的影响,通过以下步骤在基线(第0天)和研究结束(第60天)进行稳态模型评估-估计的胰岛素抵抗(HOMA-IR)测试。第一步:快速胰岛素浓度:使用标准取样管收集快速血清。在进行分析之前,对含有沉淀物的样品进行离心。测量前,样本、校准品和质控品的温度为20-25°C。由于可能的蒸发影响,分析仪上的样本、校准品和质控品在2小时内进行分析。分析的总持续时间为18分钟。分析仪自动计算胰岛素浓度(µU/mL)。第二步:快速葡萄糖水平:使用标准取样管收集快速血清样品。离心前确保完全凝块形成。ARCHITECT系统操作手册用于开发检测,系统运行以获得结果。系统自动计算葡萄糖浓度(毫克/分升)。第三步:计算:HOMA2胰岛素抵抗指数由HOMA2胰岛素抵抗计算器计算,该计算器是牛津大学糖尿病试验单位授权的工具。
安全性和耐受性:安全性和耐受性通过分析临床实验室检查结果、不良事件记录和研究者的体检进行评估。临床实验室检查包括血液学(血红蛋白、血细胞比容、白细胞计数、红细胞计数和血小板计数、MCHC、MCV)、临床化学(血糖、血清甘油三酯、LDL、HDL、总胆固醇、血清肌酐、尿素、天冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)、碱性磷酸酶、总胆红素、钠、凝血酶原时间(PT)、活化部分凝血活酶时间(aPTT)、血尿素氮(BUN)、肾小球滤过率(GFR)、尿酸、氯化物、钙、钾、白蛋白、总蛋白)和尿分析(pH、蛋白质、葡萄糖、酮体、白细胞、亚硝酸盐、血红蛋白/红细胞、尿胆素原和胆红素)。
统计分析
统计学方法包括参与者的随机化和对有效性和安全性研究结果的分析。使用SPSS 10.0版进行统计分析。将使用频率计数和百分比对所有分类变量进行描述性总结。所有连续变量将使用n、平均值、标准偏差(SD)、中值、最小值和最大值(本文中未报告中值、最小值和最大值)进行总结。使用频率计数和百分比对所有分类变量进行描述性总结。使用R软件版本4.1.2进行数据操作、描述性统计制表、推断性统计计算和图形表示。对于所有主要终点,治疗组和安慰剂之间的探索性比较将在研究结束时进行。所有次要终点都在评估安全性和耐受性,因此不会进行正式比较
样本大小和功耗考虑:参与者被随机分为积极治疗NMN组或安慰剂组。随机化代码由统计学家在研究前准备。参与者和独立终点评估者采用双盲法。治疗组和安慰剂组遵循1:1:1:1的随机比例。20名参与者被随机分配到三个治疗组(20+ 20 + 20)和安慰剂组(7+7+6),使研究所需的样本量达到80名完整的参与者(图1)。显著性水平设置为0.05 (5%)。所有终点的比较都将作为探索性的。将使用估计方法进行比较,提供95%置信区间的点估计。
功效:没有任何严重违反方案的参与者被纳入疗效分析,包括完成所有门诊中心就诊的参与者,在研究期间没有服用任何禁用药物的参与者,以及按要求完成病例报告表(CRF)的参与者。从基线到第30天和研究结束(第60天),将通过使用student t检验来评估每个对照组的血清中血细胞NAD浓度和6分钟步行耐力试验的平均功效变量。从基线到第30天和第60天,将使用Wilcoxon符号秩检验对组内进行分析,并使用Mann-Whitney U检验对组间进行分析。将估计方差分析以比较剂量,并将应用事后Tukey检验。对于非参数变量方差分析,将使用Kruskal-Wallis检验和事后Friedman检验。
安全性和耐受性:所有参加本研究的参与者,如果至少服用过一次研究产品,将被纳入安全性和耐受性分析。不良事件以总结的形式呈现,对独立事件的数量和研究期间发生不良事件的参与者的数量进行计数。此外,根据严重性、严重程度以及与研究药物的关系对总结进行了分层。对于从基线到研究结束的实验室参数变化,使用n、平均值、标准差、中值、最小值和最大值(中值、最小值和最大值不包括在本报告中)描述性总结了所有参数的变化。
该研究在ClinicalTrials.gov注册,NCT04823260,临床试验注册-印度,CTRI/2021/03/032421,并已完成。
资金来源的作用
作者之一易林是Abinopharm, Inc.这项研究的发起者和资助者。易林参与了研究设计和报告的撰写,但没有参与数据收集、数据分析和数据解释。
结果
在2021年5月25日至2021年7月8日期间,筛选了84名参与者,招募了80名健康的男性和女性中老年参与者(40-65岁)。第一位受试者于2021年5月28日给药(第一位受试者随机化)。最后一名受试者于2021年9月9日(研究结束)访问试验中心。每位参与者的研究持续时间为60天。80名参与者中有80名(100%)完成了研究,并被纳入统计分析(图1)。基线特征如表1所示。所有的人口统计变量被发现均匀地分布在各组中。在任何一组中,体重和体重指数在60天内没有统计学上的显著变化(数据未显示)。
本研究的主要终点是通过测量血液细胞内NAD水平、六分钟步行耐力试验的距离、SF-36问卷评分、生物学年龄和稳态模型评估-估计胰岛素抵抗(HOMA-IR)试验来评价NMN的抗衰老作用。次要目的是通过临床实验室试验、不良事件评估和体检,评估NMN对40-65岁健康中老年人(男性和女性)的安全性和耐受性。
血清中血液细胞内NAD浓度:在基线(第0天)、第30天和研究结束(第60天)时,从试验参与者处采集血液样本,每个参与者访问两个临床中心。然后,根据研究SOP,将临床血液样本储存并运送至临床实验室进行检测。通过使用来自MyBioSource的经验证的商业NAD测试试剂盒测量细胞内NAD浓度。它测量总的血液细胞内NAD浓度,即NAD+ + NADH的浓度。数据输入人员根据数据处理SOP向研究数据库输入数据。在研究结束时,解码随机化列表,并使用上述统计学方法分析数据。血清中血液细胞内NAD水平的结果总结在表2中。
表二安慰剂组和三个治疗组的血清中总的血液细胞内NAD浓度 | ||||
安慰剂,n = 20 | 300毫克NMN,n = 20 | 600毫克NMN,n = 20 | 900毫克NMN,n = 20 | |
基线,平均值±标准差(pmol/mL) | 8.11 ± 6.16 | 11.83 ± 11.68 | 7.95 ± 3.29 | 10.45 ± 6.79 |
30 天,平均值±标准差(pmol/mL) | 9.83 ± 8.43 | 29.78 ± 20.10 | 39.01 ± 12.59 | 43.14 ± 14.27 |
60 天,平均值±标准差(pmol/mL) | 11.77 ± 9.43 | 32.63 ± 17.86 | 45.34 ± 11.77 | 49.52 ± 19.81 |
与基线相比的变化,30天 | ||||
平均值±标准差(pmol/mL) | 1.72 ± 10.56 | 17.95 ± 20.38 | 31.06 ± 12.13 | 32.70 ± 15.35 |
平均增长(%) | 21.20% | 151.70% | 390.70% | 312.90% |
p值:治疗组与安慰剂组,30天 | 0.0004 | <0.0001 | <0.0001 | |
与基线相比的变化,60天 | ||||
平均值±标准差(pmol/mL) | 3.66 ± 8.06 | 20.80 ± 22.16 | 37.39 ± 10.92 | 38.07 ± 18.78 |
平均增长(%) | 45.10% | 175.80% | 470.30% | 364.30% |
p值:治疗组与安慰剂组,60天 | 0.0001 | <0.0001 | <0.0001 | |
p值:300毫克对600毫克,30天 | 0.0180 | |||
p值:600毫克对900毫克,30天 | 0.7098 | |||
p值:300毫克对600毫克,60天 | 0.0047 | |||
p值:600毫克对900毫克,60天 | 0.8894 | |||
与安慰剂相比,发现300毫克 NMN补充组在第30天和第60天血清中平均细胞内NAD浓度相对于基线的变化显著更高。在第30天和第60天,发现NAD浓度的平均处理差异在5%的显著性水平上具有统计学显著性(p值分别为0.0004和0.0001)。与安慰剂相比,600毫克和900毫克 NMN补充剂组获得了相似的结果。在第30天和第60天,发现NAD浓度的平均处理差异在5%的显著性水平上具有统计学显著性(所有p值均小于0.0001)。p值基于重复测量的混合模型,以NAD浓度的变化为因变量,以治疗、访视和访视交互作用为因素,以基线NAD浓度为协变量。300毫克组和600毫克组的NAD浓度相对于基线的变化具有统计学显著性差异。发现第30天的p值为0.0180,第60天的p值为0.0047。然而,没有发现600毫克和900毫克组之间有统计学上的显著差异。
六分钟步行耐力测试:六分钟步行测试是一种广泛使用的耐力和体力评估。34研究调查人员指导每个参与者在跑步机上以固定的速度和坡度行走六分钟,并记录他/她在基线(第0天)、第30天和研究结束(第60天)访问诊所中心的距离。数据录入人员根据数据处理SOP将记录的距离(米)添加到研究数据库中。研究结束后,随机列表被解码,数据被分析。统计分析的结果如表3所示。
表3安慰剂组和三个治疗组的六分钟步行耐力测试结果 | ||||
安慰剂,n = 20 | 300毫克NMN,n = 20 | 600毫克NMN, n = 20 | 900毫克NMN, n = 20 | |
基线,平均值±标准差(m) | 324.80 ± 144.41 | 307.35 ± 107.49 | 289.65 ± 92.16 | 323.25 ± 113.32 |
30天,平均值±标准差(m) | 310.00 ± 125.24 | 350.00 ± 114.71 | 400.00 ± 85.84 | 425.00 ± 140.96 |
60天,平均值±标准差(m) | 330.00 ± 117.43 | 380.00 ± 143.64 | 435.00 ± 104.00 | 480.00 ± 128.14 |
与基线相比的变化,30天 | ||||
平均值±标准差(m) | -14.80 ± 26.70 | 42.65 ± 49.84 | 110.35 ± 81.43 | 101.75 ± 79.79 |
平均增长(%) | -4.56% | 13.88% | 38.10% | 31.48% |
p值:治疗组与安慰剂组,30天 | <0.001 | <0.001 | <0.001 | |
与基线相比的变化,60天 | ||||
平均值±标准差(m) | 5.20 ± 54.96 | 72.65 ± 74.42 | 145.35 ± 84.60 | 156.75 ± 93.30 |
平均增长(%) | 1.60% | 23.64% | 50.18% | 48.49% |
p值:治疗组与安慰剂组,60天 | 0.0026 | <0.001 | <0.001 | |
p值:300毫克对600毫克,30天 | 0.0030 | |||
p值:600毫克对900毫克,30天 | 0.7377 | |||
p值:300毫克对600毫克,60天 | 0.0064 | |||
p值:600毫克对900毫克,60天 | 0.6879 | |||
比较积极治疗组和安慰剂组的p值基于重复测量的混合模型,以步行距离(米)的变化作为因变量,治疗、访视和逐访视交互作用作为因素,基线步行距离作为协变量。
与安慰剂组相比,300毫克 NMN组的步行距离相对于基线的变化具有统计学意义。p值在第30天< 0.001,而在第60天为0.0026,表明活动组行走的距离在统计学上显著高于安慰剂组。与安慰剂相比,600毫克和900毫克NMN组获得了类似的结果。300毫克组和600毫克组的6分钟步行距离的变化在统计学上有显著差异。发现第30天的p值为0.0030,第60天的p值为0.0064。然而,没有发现600毫克和900毫克组之间有统计学上的显著差异。
SF-36问卷得分:SF-36问卷是全球公认的评估一个人总体幸福感的方法。35研究调查人员在基线(第0天)、第30天和研究结束(第60天)向每位试验参与者发放了标准的36份健康相关问卷。每个问题的答案都根据标准评分指南进行评分。每个分数的总和就是总SF-36分数,由数据录入人员根据数据录入SOP将其添加到研究数据库中。研究结束后,解码随机列表,并根据统计分析协议分析SF-36评分。结果总结在表4中。
表4安慰剂组和三个治疗组的SF-36问卷得分 | ||||
安慰剂,n = 20 | 300毫克NMN,n = 20 | 600毫克NMN,n = 20 | 900毫克NMN,n = 20 | |
基线,平均值±标准差 | 121.57 ± 13.77 | 123.85 ± 12.83 | 117.61 ± 16.19 | 121.86 ± 16.65 |
30天,平均值±标准差 | 126.86 ± 12.05 | 131.45 ± 11.71 | 129.27 ± 12.47 | 135.70 ± 11.95 |
60 天,平均值±标准差 | 128.24 ± 12.91 | 136.66 ± 12.13 | 136.32 ± 12.20 | 140.25 ± 11.08 |
与基线相比的变化,30天 | ||||
平均值±标准差 | 5.29 ± 6.71 | 7.60 ± 5.46 | 11.66 ± 9.67 | 13.85 ± 8.15 |
平均增长(%) | 4.35% | 6.14% | 9.91% | 11.36% |
p值:治疗组与安慰剂组,30天 | 0.1191 | 0.0282 | <0.0001 | |
与基线相比的变化,60天 | ||||
平均值±标准差 | 6.67 ± 6.73 | 12.80 ± 9.02 | 18.71 ± 15.10 | 18.40 ± 9.51 |
平均增长(%) | 5.49% | 10.34% | 15.91% | 15.10% |
p值:治疗组与安慰剂组,60天 | 0.0073 | 0.0014 | <0.0001 | |
p值:300毫克对600毫克,30天 | 0.0785 | |||
p值:600毫克对900毫克,30天 | <0.0001 | |||
p值:300毫克对600毫克,60天 | 0.1412 | |||
p值:600毫克对900毫克,60天 | <0.0001 | |||
比较积极治疗组和安慰剂组的p值基于重复测量的混合模型,其中SF-36的变化作为因变量,治疗、访视和逐访视交互作用作为因素,基线SF-36评分作为协变量。在第60天,300毫克NMN组与安慰剂组相比,SF-36的基线变化具有统计学显著性。p值为0.0073,表明平均SF-36在统计学上显著高于安慰剂组,但在第30天,30毫克NMN组与安慰剂组的比较也不显著(p = 0.1191)。在第30天和第60天,600毫克NMN组与安慰剂组相比,SF-36的基线变化具有统计学显著性。第30天的p值为0.0282,第60天的p值为0.0014。在SF-36,在第30天和第60天,900毫克NMN组与安慰剂组之间的基线变化具有统计学显著性,其在第30天和第60天的p值均< 0.0001。在第30天(p <0.0001)和第60天(p < 0.0001),600毫克组和900毫克组之间的SF36变化具有统计学显著性差异。然而,在第30天(p = 0.0785)和第60天(p = 0.1412),未发现300毫克组和600毫克组之间有统计学显著差异。
生物年龄:经Insilico Medicine许可,通过使用Aging.Ai 3.0模型测量每个试验参与者的生物学年龄。36该模型是通过对韩国、加拿大和东欧人口的超过140,000份血液样本的临床实验室测试数据进行机器深度学习而开发的。根据我们的临床试验方案,测量了基线时(第0天)和研究结束时(第60天)的生物学年龄。在第0天和第60天收集来自每个试验参与者的临床样本,并在临床实验室进行测试。来自19类实验室测试的数据被添加到在线Aging.Ai 3.0计算器中,以生成每个参与者在第0天和第60天的生物年龄。表5总结了生物学年龄测量数据的统计分析。
表5安慰剂组和三个治疗组的生物学年龄(Ai 3.0) | ||||
安慰剂,n = 20 | 300毫克NMN,n = 20 | 600毫克NMN,n = 20 | 900毫克NMN,n = 20 | |
基线,平均值±标准差(年) | 39.80 ± 7.23 | 42.15 ± 6.03 | 45.20 ± 6.49 | 44.30 ± 7.28 |
60天,平均值±标准差(年) | 45.35 ± 8.22 | 43.65 ± 6.73 | 44.05 ± 6.37 | 45.30 ± 5.91 |
与基线相比的变化,60天 | ||||
平均值±标准差(年) | 5.55 ± 4.85 | 1.50 ± 7.19 | -1.15 ± 4.55 | 1.00 ± 6.25 |
平均增长(%) | 13.94% | 3.56% | -2.54% | 2.26% |
p值:治疗组与安慰剂组,60天 | 0.0434 | <0.0001 | 0.0141 | |
p值:300毫克对600毫克,60天 | ? | |||
p值:600毫克对900毫克,60天 | ? | |||
比较活性治疗组和安慰剂组的p值基于双样本t检验。与安慰剂相比,300毫克 NMN组在第60天的生物学年龄值存在统计学显著差异(p值0.0434)。600毫克和900毫克组观察到类似的结果(p值分别< 00001和0.0141)。
HOMA红外指数:稳态模型评估-估计胰岛素抵抗(HOMA-IR)已被广泛用于估计胰岛素抵抗。36探讨NMN对胰岛素调节向正常化HOMA的抗衰老作用。在基线时(第0天)和研究结束时(第60天),当试验参与者访问临床中心并在临床实验室测试胰岛素和葡萄糖含量时,从每个参与者的空腹血样中提取。HOMA-IR由HOMA2 IR计算器计算,该计算器是由牛津大学糖尿病试验单位授权的工具。统计分析结果总结在表6中。
表6 安慰剂组和三个治疗组的HOMA-IR | ||||
安慰剂 | 300毫克NMN | 600毫克NMN | 900毫克NMN | |
基线,平均值±标准差,n | 1.72 ± 1.58, 20 | 2.28 ± 1.43, 20 | 1.70 ± 1.05, 20 | 2.08 ± 1.27, 20 |
60天,平均值±标准差,n | 2.09 ± 1.40, 19 | 2.28 ± 1.42, 20 | 2.14 ± 1.02, 20 | 2.67 ± 1.31, 19 |
与基线相比的变化,60天 | ||||
平均值±标准差, n | 0.68 ± 1.43, 19 | -0.00 ± 1.53, 20 | 0.44 ± 0.89, 20 | 0.66 ± 1.22 |
平均增长(%) | 39.53% | 0.00% | 25.88% | 31.73% |
p值:治疗组与安慰剂组,60天 | 0.1256 | 0.1256 | 0.6197 | |
p值:300毫克对600毫克,60天 | ? | |||
p值:600毫克对900毫克,60天 | ? | |||
由于HOMA值不符合正态分布,比较活性治疗组和安慰剂组的p值基于Mann Whitney U检验。与安慰剂相比,300毫克 NMN组在第60天的HOMA值没有统计学显著差异(p值0.1256)。600毫克和900毫克组也观察到类似的结果。
安全性和耐受性:本研究的第二个目的是通过评估试验期间每个试验参与者的不良事件、实验室参数和体检来评估NMN的安全性和耐受性。
总共报告了9例不良事件(AE)。其中三个在300毫克手臂中观察到。600 毫克和900 毫克组未观察到不良事件。这些都没有发现与NMN治疗有关。
表8不良事件列表 | ||||||
筛查号/治疗 | 不良事件(AE)号 | AE的描述 | 研究者术语 | 开始日期 | 结束日期 | 因该AE而放弃? |
SCR 105/安慰剂 | 1 | 皮肤上的皮疹(前臂) | 荨麻疹 | 2011年6月6日 | 2011年6月14日 | 否 |
SCR116/安慰剂 | 1 | 四肢刺痛和麻木 | 多神经病 | 2011年6月20日 | 2011年7月3日 | 否 |
SCR 125/300毫克NMN | 1 | 酸度过高 | 急性胃炎 | 2011年6月19日 | 2011年6月21日 | 否 |
SCR139/安慰剂 | 1 | 右上肢无力 | 轻度短暂性脑缺血发作 | 2011年6月20日 | 正在进行 | 否 |
SCR139/安慰剂 | 2 | 不相干的谈话 | 精神错乱 | 2011年6月22日 | 正在进行 | 否 |
SCR213/安慰剂 | 1 | 口腔溃疡 | 口腔炎 | 2011年6月25日 | 2011年6月26日 | 否 |
SCR221/安慰剂 | 1 | 发热 | 发热 | 2011年6月25日 | 2011年6月26日 | 否 |
SCR 223/300毫克NMN | 1 | 皮肤问题 | 牛皮癣 | 2011年7月14日 | 2011年7月23日 | 否 |
SCR 223/300毫克NMN | 2 | 口腔溃疡 | 口腔炎 | 无记录 | 无记录 | 否 |
在基线(第0天)和最后一次临床中心就诊(第60天,研究结束)时,对所有参与者的临床样本(血液和尿液)进行实验室检测。三个活性组的所有实验室参数与相应的安慰剂组相比没有统计学显著差异。在任何参与者的实验室报告中都没有观察到有临床意义的异常。
表9 安慰剂组和三个治疗组的临床实验室测试结果 | ||||
安慰剂,n = 20 | 300毫克NMN,n = 20 | 600毫克NMN,n = 20 | 900毫克NMN,n = 20 | |
血红蛋白(克/分升) | ||||
基线,平均值±标准差 | 12.6 ± 1.77 | 13.5 ± 1.85 | 13.2 ± 2.02 | 13.7 ± 1.64 |
60 days, 平均值±标准差 | 13.0 ± 1.61 | 13.4 ± 2.28 | 14.0 ± 2.18 | 13.9 ± 1.87 |
与基线相比的变化,60天 | ||||
平均值±标准差 | 0.41 ± 1.06 | -0.07 ± 1.52 | 0.74 ± 0.86 | 0.16 ± 0.99 |
p值:治疗组与安慰剂组,30天 | 0.1166 | 0.2606 | 0.0379 | |
p值:治疗组与安慰剂组,60天 | 0.4854 | 0.1011 | 0.1099 | |
血细胞比容-PCV (%) | ||||
基线,平均值±标准差 | 38.2 ± 4.75 | 40.5 ± 4.30 | 40.2 ± 5.07 | 41.2 ± 4.50 |
60天,平均值±标准差 | 41.3 ± 4.50 | 59.2 ± 80.68 | 43.0 ± 5.56 | 42.5 ± 4.82 |
与基线相比的变化,60天 | ||||
平均值±标准差 | 3.05 ± 3.98 | 18.70 ± 80.73 | 2.75 ± 2.10 | 1.26 ± 2.11 |
p值:治疗组与安慰剂组,30天 | 0.1231 | 0.2003 | 0.0456 | |
p值:治疗组与安慰剂组,60天 | 0.328 | 0.2890 | 0.4097 | |
MCHC | ||||
基线,平均值±标准差 | 32.8 ± 1.20 | 33.1 ± 1.34 | 32.9 ± 1.24 | 33.2 ± 0.85 |
60天,平均值±标准差 | 31.8 ± 1.21 | 32.3 ± 1.16 | 32.5 ± 1.17 | 32.6 ± 1.04 |
与基线相比的变化,60天 | ||||
平均值±标准差 | -0.95 ± 0.54 | -0.84 ± 0.98 | -0.37 ± 0.68 | -0.61 ± 1.21 |
p值:治疗组与安慰剂组,30天 | 0.3704 | 0.8369 | 0.1733 | |
p值:治疗组与安慰剂组,60天 | 0.2187 | 0.0923 | 0.0341 | |
MCV | ||||
基线,平均值±标准差 | 83.1 ± 13.01 | 87.6 ± 8.48 | 86.2 ± 6.74 | 88.4 ± 8.95 |
60天,平均值±标准差 | 85.0 ± 12.42 | 91.9 ± 11.57 | 88.3 ± 6.82 | 88.1 ± 8.55 |
与基线相比的变化,60天 | ||||
平均值±标准差 | 1.90 ± 5.09 | 4.30 ± 8.99 | 2.10 ± 3.13 | 0.25 ± 7.40 |
p值:治疗组与安慰剂组,30天 | 0.2077 | 0.3576 | 0.1452 | |
p值:治疗组与安慰剂组,60天 | 0.079 | 0.3114 | 0.3636 | |
白细胞总数-白细胞总数(/cmm) | ||||
基线,平均值±标准差 | 7160.0 ± 1538.42 | 7325.0 ± 2131.68 | 7005.0 ± 1737.05 | 6780.0 ± 1379.40 |
60天,平均值±标准差 | 7475.0 ± 1873.60 | 7835.0 ± 2899.96 | 7930.0 ± 2488.94 | 7505.0 ± 1720.61 |
与基线相比的变化,60天 | ||||
平均值±标准差 | 315.0 ± 1592.18 | 510.00 ± 1811.34 | 925.00 ± 2070.31 | 725.00 ± 1379.88 |
p值:治疗组与安慰剂组,30天 | 0.6437 | 0.7668 | 0.4159 | |
p值:治疗组与安慰剂组,60天 | 0.5176 | 0.9582 | ||
绝对中性粒细胞(/cmm) | ||||
基线,平均值±标准差 | 4218.0 ± 1265.00 | 4133.6 ± 1558.56 | 4068.0 ± 1244.81 | 3805.9 ± 1045.89 |
60天,平均值±标准差 | 4139.8 ± 1264.89 | 4275.2 ± 1846.43 | 4135.1 ± 1561.35 | 3910.1 ± 986.63 |
与基线相比的变化,60天 | ||||
平均值±标准差 | -78.14 ± 119.59 | 141.61 ± 1178.93 | 67.1±1071.50 | 104.18 ± 992.44 |
p值:治疗组与安慰剂组,60天 | 0.8518 | 0.7075 | 0.2686 | |
p值:治疗组与安慰剂组,30天 | 0.7883 | 0.9917 | 0.5257 | |
中性粒细胞(%) | ||||
基线,平均值±标准差 | 58.5 ± 7.70 | 55.5 ± 7.69 | 57.7 ± 8.18 | 55.6 ± 6.92 |
60天,平均值±标准差 | 55.8 ± 6.99 | 53.3 ± 8.12 | 51.7 ± 8.12 | 52.3 ± 7.97 |
与基线相比的变化,60天 | ||||
平均值±标准差 | -2.69 ± 6.15 | -2.27 ± 6.36 | -5.97 ± 6.66 | -3.30 ± 7.30 |
p值:治疗组与安慰剂组,30天 | 0.2244 | 0.7399 | 0.2179 | |
p值:治疗组与安慰剂组,60天 | 0.2865 | 0.0940 | 0.1467 | |
淋巴细胞(%) | ||||
基线,平均值±标准差 | 34.1 ± 6.31 | 37.5 ± 7.35 | 34.5 ± 7.34 | 36.3 ± 6.23 |
60天,平均值±标准差 | 35.4 ± 7.46 | 37.1 ± 7.42 | 39.2 ± 7.36 | 37.3 ± 6.05 |
与基线相比的变化,60天 | ||||
平均值±标准差 | 1.28 ± 5.27 | -0.41 ± 5.75 | 4.67 ± 6.23 | 1.06 ± 6.02 |
p值:治疗组与安慰剂组,30天 | 0.1280 | 0.8490 | 0.2907 | |
p值:治疗组与安慰剂组,60天 | 0.4793 | 0.1125 | 0.3792 | |
单核细胞(%) | ||||
基线,平均值±标准差 | 3.5 ± 1.02 | 3.8 ± 1.30 | 4.1 ± 1.42 | 3.8 ± 1.58 |
60天,平均值±标准差 | 5.5 ± 1.49 | 5.5 ± 1.29 | 5.4 ± 1.53 | 5.5 ± 1.62 |
与基线相比的变化,60天 | ||||
平均值±标准差 | 1.92 ± 0.89 | 1.70 ± 1.78 | 1.30 ± 1.44 | 1.77 ± 1.21 |
p值:治疗组与安慰剂组,30天 | 0.4854 | 0.1485 | 0.5958 | |
p值:治疗组与安慰剂组,60天 | 0.9369 | 0.9253 | 0.8797 | |
嗜碱性粒细胞(%) | ||||
基线,平均值±标准差 | 0.00 ± 0.02 | 0.00 ± 0.03 | 0.0 ± 0.02 | 0.0 ± 0.00 |
60天,平均值±标准差 | 0.00 ± 0.04 | 0.00 ± 0.02 | 0.0 ± 0.16 | 0.0 ± 0.02 |
与基线相比的变化,60天 | ||||
平均值±标准差 | 0.00 ± 0.03 | 0.00 ± 0.04 | 0.03 ± 0.16 | 0.00 ± 0.02 |
p值:治疗组与安慰剂组,30天 | 0.5602 | >0.999 | 0.3236 | |
p值:治疗组与安慰剂组,60天 | >0.9990 | 0.4015 | >0.999 | |
嗜酸性粒细胞(%) | ||||
基线,平均值±标准差 | 3.80 ± 3.91 | 3.20 ± 2.29 | 3.6 ± 2.89 | 4.4 ± 2.57 |
60天,平均值±标准差 | 3.60 ± 2.78 | 4.20 ± 2.49 | 3.6 ± 2.75 | 4.8 ± 4.16 |
与基线相比的变化,60天 | ||||
平均值±标准差 | -0.20 ± 2.83 | 1.01 ± 2.11 | -0.03 ± 1.84 | 0.45 ± 3.33 |
p值:治疗组与安慰剂组,30天 | 0.5381 | 0.8910 | 0.5992 | |
p值:治疗组与安慰剂组,60天 | 0.485 | 0.9774 | 0.2841 | |
血小板计数(/cmm) | ||||
基线,平均值±标准差 | 289200 ± 61258.38 | 279450 ± 79343.01 | 280450 ± 84405.33 | 293450 ± 77476.97 |
60天,平均值±标准差 | 303900 ± 69230.28 | 321600 ± 86506.71 | 311200 ± 85234.41 | 319850 ± 87593.72 |
与基线相比的变化,60天 | ||||
平均值±标准差 | 14700.00 ± 38335.22 | 42150.00 ± 77332.01 | 30750.00 ± 42127.47 | 26400.00 ± 64362.79 |
p值:治疗组对比安慰剂,30天 | 0.6660 | 0.7096 | 0.8484 | |
p值:治疗组对比安慰剂,60天 | 0.4793 | 0.7679 | 0.5267 | |
红细胞(RBC)计数(百万/cmm) | ||||
基线,平均值±标准差 | 4.7 ± 0.94 | 4.6 ± 0.33 | 4.7 ± 0.49 | 4.7 ± 0.60 |
60天,平均值±标准差 | 4.9 ± 0.79 | 4.6 ± 0.69 | 4.9 ± 0.54 | 4.9 ± 0.66 |
与基线相比的变化,60天 | ||||
平均值±标准差 | 0.18 ± 0.43 | -0.08 ± 0.63 | 0.19 ± 0.20 | 0.14 ± 0.45 |
p值:治疗组对比安慰剂,30天 | 0.7188 | 0.9016 | 0.9936 | |
p值:治疗组对比安慰剂,60天 | 0.1600 | 0.9557 | 0.8680 | |
血清甘油三酯 | ||||
基线,平均值±标准差 | ? ± ? | ? ± ? | ? ± ? | ? ± ? |
60天,平均值±标准差 | ? ± ? | ? ± ? | ? ± ? | ? ± ? |
与基线相比的变化,60天 | ||||
平均值±标准差 | 5.38 ± 58.90 | -21.41 ± 83.21 | -21.78 ± 52.83 | -28.52 ± 58.86 |
p值:治疗组与安慰剂组,60天 | ||||
LDL | ||||
基线,平均值±标准差 | ? ± ? | ? ± ? | ? ± ? | ? ± ? |
60天,平均值±标准差 | ? ± ? | ? ± ? | ? ± ? | ? ± ? |
与基线相比的变化,60天 | ||||
平均值±标准差 | 4.56 ± 29.27 | -5.19 ± 30.36 | 9.84 ± 30.91 | 13.23 ± 17.34 |
p值:治疗组与安慰剂组,60天 | ||||
HDL | ||||
基线,平均值±标准差 | 42.40 ± 9.96 | 43.80 ± 12.28 | 41.8 ± 5.64 | 40.5 ± 8.18 |
60天,平均值±标准差 | 47.90 ± 14.00 | 45.10 ± 15.78 | 45.9 ± 9.42 | 45.2 ± 9.05 |
与基线相比的变化,60天 | ||||
平均值±标准差 | 5.51 ± 13.85 | 1.26 ± 11.83 | 4.04 ± 5.71 | 4.69 ± 5.47 |
p值:治疗组对比安慰剂,30天 | 0.6850 | 0.8385 | 0.5224 | |
p值:治疗组对比安慰剂,60天 | 0.5541 | 0.5981 | 0.4757 | |
总胆固醇 | ||||
基线,平均值±标准差 | 170.9 ± 32.04 | 176.3 ± 32.13 | 179.2 ± 25.68 | 190.4 ± 46.72 |
60天,平均值±标准差 | 180.2 ± 30.56 | 167.2 ± 27.83 | 184.6 ± 30.61 | 199.7 ± 40.68 |
与基线相比的变化,60天 | ||||
平均值±标准差 | 9.29 ± 24.43 | -9.05 ± 32.04 | 5.38 ± 33.26 | 9.25 ± 17.80 |
p值:治疗组对比安慰剂,30天 | 0.6024 | 0.3737 | 0.1326 | |
p值:治疗组对比安慰剂,60天 | 0.1674 | 0.6554 | 0.0957 | |
血清肌酸 | ||||
基线,平均值±标准差 | 0.7 ± 0.19 | 0.8 ± 0.15 | 0.7 ± 0.15 | 0.8 ± 0.20 |
60天,平均值±标准差 | 0.8 ± 0.20 | 0.8 ± 0.19 | 0.8 ± 0.20 | 0.9 ± 0.21 |
与基线相比的变化,60天 | ||||
平均值±标准差 | 0.08 ± 0.07 | 0.05 ± 0.11 | 0.04 ± 0.07 | 0.06 ± 0.07 |
p值:治疗组对比安慰剂,30天 | 0.6747 | 0.7179 | 0.2371 | |
p值:治疗组对比安慰剂,60天 | 0.9345 | 0.7241 | 0.3917 | |
尿素 | ||||
基线,平均值±标准差 | 17.6 ± 5.29 | 18.3 ± 5.35 | 18.7 ± 5.94 | 19.9 ± 7.05 |
60天,平均值±标准差 | 18.7 ± 4.98 | 18.9 ± 6.10 | 18.5 ± 3.24 | 21.0 ± 7.06 |
与基线相比的变化,60天 | ||||
平均值±标准差 | 1.07 ± 3.46 | 0.56 ± 4.02 | -0.15 ± 4.86 | 1.1 ± 6.03 |
p值:治疗组对比安慰剂,30天 | 0.6774 | 0.5657 | 0.2524 | |
p值:治疗组对比安慰剂,60天 | 0.908 | 0.8900 | 0.2334 | |
AST | ||||
基线,平均值±标准差 | 23.20 ± 6.99 | 22.40 ± 6.19 | 20.9 ± 5.49 | 29.9 ± 21.40 |
60天,平均值±标准差 | 22.40 ± 6.66 | 21.60 ± 6.96 | 22.2 ± 5.39 | 22.0 ± 7.18 |
与基线相比的变化,60天 | ||||
平均值±标准差 | -0.76 ± 4.44 | -0.87 ± 7.31 | 1.28 ± 3.53 | -7.92 ± 21.68 |
p值:治疗组对比安慰剂,30天 | 0.7126 | 0.2564 | 0.1892 | |
p值:治疗组对比安慰剂,60天 | 0.6817 | 0.8927 | 0.8418 | |
ALT | ||||
基线,平均值±标准差 | 20.60 ± 9.22 | 23.70 ± 11.69 | 17.5 ± 6.72 | 32.3 ± 35.83 |
60天,平均值±标准差 | 19.40 ± 7.91 | 19.60 ± 9.41 | 17.7 ± 7.04 | 20.2 ± 8.77 |
与基线相比的变化,60天 | ||||
平均值±标准差 | -1.21 ± 6.89 | -4.09 ± 8.02 | 0.22 ± 4.44 | -12.12 ± 36.59 |
p值:治疗组对比安慰剂,30天 | 0.3509 | 0.2311 | 0.1640 | |
p值:治疗组对比安慰剂,60天 | 0.9237 | 0.4851 | 0.7537 | |
碱性磷酸酶 | ||||
基线,平均值±标准差 | 84.10 ± 22.35 | 83.70 ± 22.59 | 87.2 ± 22.15 | 87.2 ± 22.91 |
60天,平均值±标准差 | 89.80 ± 25.07 | 96.60 ± 25.91 | 90.0 ± 26.49 | 94.4 ± 25.89 |
与基线相比的变化,60天 | ||||
平均值±标准差 | 5.66 ± 17.99 | 12.88 ± 14.38 | 2.78 ± 16.02 | 7.21 ± 11.04 |
p值:治疗组对比安慰剂,30天 | 0.9498 | 0.6666 | 0.6754 | |
p值:治疗组对比安慰剂,60天 | 0.4059 | 0.9825 | 0.5735 | |
胆红素(总) | ||||
基线,平均值±标准差 | 0.5 ± 0.24 | 0.60 ± 0.32 | 0.6 ± 0.38 | 0.5 ± 0.41 |
60天,平均值±标准差 | 0.60 ± 0.23 | 0.60 ± 0.26 | 0.6 ± 0.27 | 0.5 ± 0.43 |
与基线相比的变化,60天 | ||||
平均值±标准差 | 0.03 ± 0.20 | 0.02 ± 0.21 | 0.01 ± 0.27 | 0.04 ± 0.17 |
p值:治疗组对比安慰剂,30天 | 0.5592 | 0.4196 | 0.7004 | |
p值:治疗组对比安慰剂,60天 | 0.6658 | 0.4437 | 0.7700 | |
血清钠 | ||||
基线,平均值±标准差 | 137.3 ± 3.95 | 140.1 ± 2.25 | 139.8 ± 2.92 | 139.2 ± 2.37 |
60天,平均值±标准差 | 139.8 ± 2.07 | 140.2 ± 2.07 | 140.5 ± 2.21 | 140.3 ± 2.69 |
与基线相比的变化,60天 | ||||
平均值±标准差 | 2.50 ± 2.96 | 0.10 ± 2.94 | 0.75 ± 2.88 | 1.10 ± 3.31 |
p值:治疗组对比安慰剂,30天 | 0.0089 | 0.0316 | 0.0803 | |
p值:治疗组对比安慰剂,60天 | 0.5443 | 0.3077 | 0.5568 | |
凝血酶原时间 | ||||
基线,平均值±标准差 | 11.6 ± 0.55 | 12.3 ± 1.57 | 11.8 ± 0.56 | 11.9 ± 0.66 |
60天,平均值±标准差 | 12.0 ± 0.87 | 12.5 ± 1.43 | 11.9 ± 1.04 | 11.9 ± 0.67 |
与基线相比的变化,60天 | ||||
平均值±标准差 | 0.39 ± 0.76 | 0.27 ± 1.56 | 0.18 ± 0.81 | -0.08 ± 1.10 |
p值:治疗组对比安慰剂,30天 | 0.0706 | 0.3024 | 0.0713 | |
p值:治疗组对比安慰剂,60天 | 0.1393 | 0.9084 | 0.6411 | |
活化部分凝血活酶时间(aPTT) | ||||
基线,平均值±标准差 | 33.5 ± 3.13 | 33.0 ± 4.34 | 33.1 ± 5.11 | 32.6 ± 4.72 |
60天,平均值±标准差 | 34.1 ± 6.57 | 32.7 ± 3.71 | 31.6 ± 3.81 | 31.1 ± 3.29 |
与基线相比的变化,60天 | ||||
平均值±标准差 | 0.57 ± 6.10 | -0.20 ± 4.61 | -1.52 ± 3.62 | -1.50 ± 5.55 |
p值:治疗组对比安慰剂,30天 | 0.6572 | 0.7924 | 0.4990 | |
p值:治疗组对比安慰剂,60天 | 0.4420 | 0.1564 | 0.0809 | |
血尿素氮(BUN) | ||||
基线,平均值±标准差 | 8.20 ± 2.46 | 8.60 ± 8.25 | 8.7 ± 2.77 | 9.3 ± 3.29 |
60天,平均值±标准差 | 8.80 ± 2.33 | 8.70 ± 2.91 | 8.6 ± 1.51 | 9.8 ± 3.30 |
与基线相比的变化,60天 | ||||
平均值±标准差 | 0.56 ± 1.66 | 0.18 ± 1.84 | -0.08 ± 2.28 | 0.51 ± 2.82 |
p值:治疗组对比安慰剂,30天 | 0.6672 | 0.5617 | 0.2476 | |
p值:治疗组对比安慰剂,60天 | 0.9572 | 0.8106 | 0.2589 | |
尿酸氮 | ||||
基线,平均值±标准差 | 5.4 ± 1.38 | 5.1 ± 1.20 | 4.5 ± 1.68 | 7.6 ± 0.54 |
60天,平均值±标准差 | 5.5 ± 1.06 | 5.1 ± 1.56 | 4.4 ± 1.58 | 5.2 ± 1.31 |
与基线相比的变化,60天 | ||||
平均值±标准差 | 0.13 ± 0.81 | -0.06 ± 1.23 | -0.08 ± 0.80 | -0.16 ± 0.92 |
p值:治疗组对比安慰剂,30天 | 0.5131 | 0.0904 | 0.9712 | |
p值:治疗组对比安慰剂,60天 | 0.4182 | 0.0175 | 0.4607 | |
肾小球滤过率(GFR) | ||||
基线,平均值±标准差 | 110.40 ± 24.81 | 104.60 ± 18.20 | 99.1 ± 15.83 | 96.8 ± 17.63 |
60天,平均值±标准差 | 100.40 ± 23.72 | 99.50 ± 22.66 | 95.5 ± 18.24 | 89.0 ± 16.49 |
与基线相比的变化,60天 | ||||
平均值±标准差 | -9.95 ± 10.10 | -5.15 ± 18.31 | -3.55 ± 9.40 | -7.80 ± 8.29 |
p值:治疗组对比安慰剂,30天 | 0.4086 | 0.0941 | 0.0529 | |
p值:治疗组对比安慰剂,60天 | 0.8976 | 0.4685 | 0.0842 | |
血清氯化物 | ||||
基线,平均值±标准差 | 99.6 ± 4.66 | 102.2 ± 2.71 | 101.7 ± 2.86 | 101.2 ± 2.55 |
60天,平均值±标准差 | 101.5 ± 2.26 | 102.2 ± 2.74 | 101.5 ± 2.26 | 101.7 ± 2.53 |
与基线相比的变化,60天 | ||||
平均值±标准差 | 1.86 ± 3.95 | 0.0±3.07 | -0.16 ± 2.79 | 0.46 ± 2.18 |
p值:治疗组对比安慰剂,30天 | 0.0384 | 0.0955 | 0.178 | |
p值:治疗组对比安慰剂,60天 | 0.3609 | 0.9336 | 0.7633 | |
血清钾 | ||||
基线,平均值±标准差 | 4.5 ± 0.39 | 4.1 ± 0.25 | 4.3 ± 0.47 | 4.4 ± 0.47 |
60天,平均值±标准差 | 4.7 ± 0.32 | 4.6 ± 0.36 | 4.6 ± 0.38 | 4.5 ± 0.42 |
与基线相比的变化,60天 | ||||
平均值±标准差 | 0.21 ± 0.44 | 0.47 ± 0.37 | 0.24 ± 0.39 | 0.10 ± 0.47 |
p值:治疗组对比安慰剂,30天 | 0.0024 | 0.2785 | 0.4709 | |
p值:治疗组对比安慰剂,60天 | 0.4941 | 0.326 | 0.097 | |
血钙 | ||||
基线,平均值±标准差 | 9.2 ± 0.44 | 9.3 ± 0.30 | 9.2 ± 0.29 | 9.3 ± 0.42 |
60天,平均值±标准差 | 9.4 ± 0.45 | 9.5 ± 0.40 | 9.4 ± 0.37 | 9.5 ± 0.49 |
与基线相比的变化,60天 | ||||
平均值±标准差 | 0.21 ± 0.46 | 0.24 ± 0.35 | 0.26 ± 0.25 | 0.20 ± 0.48 |
p值:治疗组对比安慰剂,30天 | 0.4549 | 0.8344 | 0.4461 | |
p值:治疗组对比安慰剂,60天 | 0.3994 | 0.909 | 0.5714 | |
白蛋白 | ||||
基线,平均值±标准差 | 4.40 ± 0.29 | 4.40 ± 0.27 | 4.3 ± 0.32 | 4.4 ± 0.22 |
60天,平均值±标准差 | 4.30 ± 0.32 | 4.40 ± 0.33 | 4.5 ± 0.35 | 4.4 ± 0.36 |
与基线相比的变化,60天 | ||||
平均值±标准差 | -0.10 ± 0.39 | 0.05 ± 0.40 | 0.18 ± 0.30 | -0.0±0.36 |
p值:治疗组对比安慰剂,30天 | 0.4334 | 0.1873 | 0.8539 | |
p值:治疗组对比安慰剂,60天 | 0.4705 | 0.1652 | 0.4873 | |
总蛋白质 | ||||
基线,平均值±标准差 | 7.2 ± 0.46 | 7.1 ± 0.41 | 7.2 ± 0.44 | 7.2 ± 0.32 |
60天,平均值±标准差 | 7.5 ± 0.45 | 7.7 ± 0.47 | 7.5 ± 0.61 | 7.6 ± 0.54 |
与基线相比的变化,60天 | ||||
平均值±标准差 | 0.30 ± 0.51 | 0.60 ± 0.52 | 0.3±0.53 | 0.41 ± 0.58 |
p值:治疗组对比安慰剂,30天 | 0.3017 | 0.6753 | 0.6072 | |
p值:治疗组对比安慰剂,60天 | 0.2782 | 0.7262 | 0.7513 | |
当每个试验参与者在第0天、第30天和第60天访问临床中心时,由研究主要研究者对所有参与者进行体检。研究期间,未发现生命体征、身体检查结果或任何其他观察结果方面有临床意义的异常。
总之,我们的临床试验证实,在60天内,每天服用300毫克、600毫克和900毫克的研究剂量的NMN是安全的。
讨论
我们的NMN人体临床试验是一项多中心、随机、平行、双盲、安慰剂对照、剂量依赖性和四组临床试验,对80名年龄在40-65岁之间的健康男性和女性参与者进行NMN补充剂300毫克、600毫克和900毫克NMN口服剂量的研究。我们研究了口服NMN补充剂是否能提高中老年人的细胞NAD水平。与此同时,我们通过测量试验参与者的六分钟步行距离、SF-36问卷得分和HOMA-IR来评估NMN是否可以改善与年龄相关的健康问题和身体虚弱。第三,我们评估了NMN补充剂是否会对人类的生物学年龄产生影响。最后,我们研究了NMN对健康成人的安全性和耐受性。
对小鼠的研究已经清楚地表明,口服NMN摄入可以被快速吸收,有效地运输到血液循环中,并在各种组织如血液、肝脏、骨骼肌等处立即转化为NAD。12但是,在很长一段时间里,人们不清楚NMN是如何被吸收并进入细胞的。2016年,Ratajczak等人报道,哺乳动物细胞需要将胞外NMN转化为NR,即烟酰胺核苷,以便细胞摄取和NAD+合成。37然而,在2019年,今井教授的实验室披露了他们在小鼠身上发现了一种新的NMN特异性细胞膜转运蛋白Slc12a8,它可以通过快速转运NMN分子进入细胞,帮助小鼠肠道直接吸收NMN,NMN在细胞内迅速转化为胞内NAD。38这些结果能转移到人类身上吗?当这项研究被设计时,没有发表的人类临床试验显示口服NMN补充剂确实可以显著增加人类细胞内NAD水平。来自庆应义塾大学28和圣路易斯华盛顿大学29的前两项已发表的人类临床试验没有发现NMN补充剂增加细胞内NAD浓度的直接证据。2020年发表的庆应义塾大学的研究只发现了血浆中NMN代谢物的显著增加,但没有提到口服NMN治疗后NAD水平的变化。这华盛顿大学2021年发表的试验报告了血浆和骨骼肌中NMN代谢物的显著升高,但是骨骼肌中NAD水平的变化不显著,并且根本没有报告血浆中的NAD水平,尽管发现基础外周单核细胞(BPMC)中的NAD水平显著升高。最近,东京大学以在线预印本的形式公布了他们在2021年进行的人体临床试验,其中NMN的口服剂量为250毫克,每天一次。31他们是第一个证明NMN补充剂显著提高全血NMN和NAD浓度的人,但他们的试验只对健康男性参与者使用了固定剂量。Metro International Biotech最近也以在线预印本的形式发表了他们的人类临床试验,并披露了他们对肥胖参与者每天一次或每天两次服用1000毫克 NMN 14天的研究,结果显示血液NMN和NAD浓度具有统计学显著性和剂量依赖性增加。33然而,他们只招募了少量肥胖成年人,在非常短的试验期内服用超高剂量的NMN。另外两个发表的关于NMN的人类临床试验根本没有测量NAD的浓度。基于这些发现,仍然需要对健康的男性和女性成年人进行更多的NMN临床试验,以清楚地证明细胞内NAD浓度的剂量依赖性增加,这也可以为NMN补充剂的最佳剂量提供线索。
表1总结了我们研究的平均血液细胞内NAD变化的结果。与安慰剂相比,在第30天和第60天,300毫克、600毫克和900毫克 NMN组的NAD水平相对于基线的平均变化均具有统计学显著性和剂量依赖性增加。治疗组内的比较显示,在第30天和第60天,细胞内NAD从300毫克组增加到600毫克组,具有统计学显著性,而在第30天和第60天,没有观察到NAD水平从600毫克组增加到900毫克组,具有统计学显著性。当在不同时间点比较同一治疗组时,治疗时间越长,300毫克NMN组(第60天23.64%对第30天13.88%)、600毫克NMN组(第60天50.18%对第30天38.10%)和900毫克NMN组(第60天48.49%对第30天31.48%)的细胞内NAD水平增加越高。我们得出结论,我们的研究首次揭示了NMN每日口服剂量从300毫克、600毫克到900毫克时,血液细胞内NAD水平呈剂量依赖性增加,而血液细胞内NAD浓度的增加在600毫克剂量时达到平稳。
此前有报道称,在老龄小鼠中补充NMN可提高NAD水平,改善体力活动18和耐力20。我们的六分钟步行耐力测试结果显示,与安慰剂相比,在所有三个NMN剂量和时间点,六分钟内走过的距离有统计学显著增加,并证实NMN补充剂对老年小鼠和老年人都有类似的效果。这一观察结果也与之前的人体临床试验一致,即补充NMN可以提高骨骼肌代谢功能29、肌肉对氧气的利用率30、肌肉强度31和下肢功能32。肌肉退化是老年人身体虚弱的主要原因。我们的研究进一步证实,NMN可以通过维持甚至恢复肌肉健康来起到恢复老年人体力的作用。
以前的人类临床试验已经评估了NMN治疗的整体健康状况的某些方面,并产生了不同的结果。28-32 SF-36问卷是全球公认的评估人们总体健康状况的健康调查。我们对SF-36评估的研究结果表明,NMN补充剂改善了老年人的整体健康状况。该研究表明,更高的剂量和更长的NMN治疗给出了更好的SF-36分数,这表明参与者的整体健康状况更好。例如,我们的研究表明,与基线的平均变化相比,300毫克NMN组在第30天的SF-36评分不显著,而在第60天则显著。当在第30天的相同时间点观察时,600毫克和900毫克组的SF-36评分显著高于安慰剂组,但300毫克组不显著。据我们所知,我们是第一个使用SF-36系统评估NMN治疗对人类总体健康影响的人。然而,要看到更好的趋势,建议超过60天的更长的研究期。
近年来,生物年龄在抗衰老研究领域越来越受到关注。6,39已经开发了许多不同类型的生物学年龄时钟,例如表观遗传时钟(DNA甲基化)、端粒长度、转录年龄、复合生物标记预测器等,它们可以被分类为基于分子和表型生物标记。6一个好的生物标记应该是准确预测一个人的寿命和健康寿命。我们利用老化。Insilico Medicine开发的Ai 3.0模型,用于评估NMN治疗对人类生物学年龄的影响。Insilico Medicine团队使用来自韩国、加拿大和东欧人口的超过140,000份血液样本的临床实验室测试数据的机器深度学习来开发Agin。Ai 3.0算法,并用来自国家健康和营养检查调查(NHANES)数据集的超过55,000个样本验证了他们的模型。36这种生物年龄时钟,也称为血液学时钟,使用19个血液测试参数来计算人类的生物年龄。在人类临床研究中,我们首次调查了NMN对人类生物学年龄的影响,并发现与安慰剂相比,NMN治疗对人类生物学年龄的改善具有统计学意义。如表5所示,NMN治疗组的所有生物学年龄的增加在统计学上均小于安慰剂组。600毫克NMN治疗组甚至在60天后平均年轻了1.15岁。虽然趋势非常好,但超过60天的临床试验可以帮助评估NMN治疗是否能够以统计学显著的方式逆转生物学年龄。
先前有一项临床研究报道,补充NMN可以增加糖尿病前期和肥胖女性成人的骨骼肌胰岛素敏感性。29稳态模型评估-估计胰岛素抵抗(HOMA-IR)已被广泛用于估计胰岛素敏感性。36我们测量了空腹血胰岛素和葡萄糖含量的HOMA-IR值,发现与安慰剂相比,NMN治疗组没有出现统计学上的显著变化。我们的结果表明,健康成年人有正常的HOMA-IR值,NMN治疗可以帮助维持他们的HOMA-IR值在正常范围内,或者对HOMA-IR没有影响。需要进一步研究才能得出明确的结论。
最后,我们的研究表明,每日口服900毫克的NMN补充剂是安全且耐受性良好的。记录了9例不良事件,其中无一例与NMN治疗有关。如表9所示,所有实验室测试参数未显示异常变化。在所有三个剂量的60天NMN治疗期间,体检没有记录任何身体恶化。
利益申报
数据共享
贡献者
致谢
参考
1 Sinclair DA, and LaPlante MD. Lifespan: Why We Age – and Why We Don’t Have To. New York: Altria Books, 2019.
2 Bulterijs S, Hull RS, Björk VCE, Roy AG. It is time to classify biological aging as a disease. Front. Genet. 18 June 2015. https://doi.org/10.3389/fgene.2015.00205.
3 Crimmins EM. Lifespan and healthspan: past, present, and promise. The Gerontologist 2015; 55: 901–911. https://doi.org/10.1093/geront/gnv130.
4 Ayyadevara S, Alla R, Thaden JJ, Shmookler Reis RJ. Remarkable longevity and stress resistance of nematode PI3K-null mutants. Aging Cell 2008; 7(1):13-22. doi: 10.1111/j.1474–9726.2007.00348.x.
5 Bartke A, Wright J C, Mattison, J A, Ingram D K, Miller R A, Roth, G S. Extending the lifespan of long–lived mice. Nature 2001; 414: 412. doi: 10.1038/35106646
6 Jylhävä J, Pedersen NL, and Hägg S. (2017). Biological Age Predictors. EBioMedicine2017; 21: 29–36. doi: 10.1016/j.ebiom.2017.03.046
7 Kaetberlein, M. (2018). How healthy is the healthspan Concept? GeroScience. 2018; 40(4) 361–364. doi: 10.1007/s11357-018-0036-9
8 Robbins, PD, Niedernhofer, L J. Advances in therapeutic approaches to extend healthspan: a perspective from the 2nd Scripps symposium on the biology of aging. Aging Cell2017; 16(4): 610–614. doi: 10.1111/acel.12620
9 Fahy GM, Brooke RT, Watson JP, et al. Reversal of epigenetic aging and immunosenescent trends in humans. Aging Cell. 2019;18(6):e13028. doi:10.1111/acel.13028
10 Zhang B, Trapp A, Kerepesi C, Gladyshev VN. Emerging rejuvenation strategies-reducing the biological age. Aging Cell 2022; 21(1): e13538. doi: 10.1111/acel.13538.
11 López-Otín C, Blasco MA, Partridge L, Serrano M, Kroemer G. The hallmarks of aging. Cell 2013;153(6):1194-1217. doi:10.1016/j.cell.2013.05.039
12 Rajman L, Chwalek K, Sinclair DA. Therapeutic Potential of NAD-Boosting Molecules: The In Vivo Evidence. Cell Metab 2018; 27(3): 529-547. doi: 10.1016/j.cmet.2018.02.011.
13 Aman Y, Qiu Y, Tao J, Fang EF. Therapeutic potential of boosting NAD+ in aging and age–related diseases. Translational Medicine of Aging 2018; 2: 30-37. https://doi.org/10.1016/j.tma.2018.08.003.
14 van der Rijt S, Molenaars M, McIntyre RL, Janssens GE, Houtkooper RH. Integrating the Hallmarks of Aging Throughout the Tree of Life: A Focus on Mitochondrial Dysfunction. Front Cell Dev Biol. 2020; 8: 594416. doi: 10.3389/fcell.2020.594416.
15 Colon N, Ford D. A systems–approach to NAD+ restoration. Biochemical Pharmcology 2022; 198: https://doi.org/10.1016/j.bcp.2022.114946
16 Shade C. The Science Behind NMN-A Stable, Reliable NAD+Activator and Anti-Aging Molecule. Integr Med (Encinitas). 2020;19(1):12-14.
17 Nadeeshani H, Li JY, Ying, TL, Zhang, BH, Lu, J. (2021). Nicotinamide Mononucleotide (NMN) as An Anti-aging Health Product – Promises and Safety Concerns, J. Adv. Res. 2022; 37: 267–278. https://doi.org/10.1016/j.jare.2021.08.003
18 Mills KF, Yoshida S, Stein LR, et al. Long-term administration of nicotinamide mononucleotide mitigates age-associated physiological decline in mice. Cell Metab. 2016;24(6):795-806. doi: 10.1016/j.cmet.2016.09.013.
19 Tarantini S, Valcarcel-Ares MN, Toth P, et al. Nicotinamide mononucleotide (NMN) supplementation rescues cerebromicrovascular endothelial function and neurovascular coupling responses and improves cognitive function in aged mice. Redox Biol. 2019; 24:101192. doi: 10.1016/j.redox.2019.101192.
20 Das A, Huang GX, Bonkowski MS, et al. Impairment of an Endothelial NAD+-H2S Signaling Network Is a Reversible Cause of Vascular Aging [published correction appears in Cell 2019;176(4):944-945]. Cell 2018;173(1): 74-89.e20. doi:10.1016/j.cell.2018.02.008
21 Huang RX, Tao J. Nicotinamide mononucleotide attenuates glucocorticoid‑induced osteogenic inhibition by regulating the SIRT1/PGC‑1α signaling pathway. Mol Med Rep. 2020; 22(1): 145-154. doi: 10.3892/mmr.2020.11116.
22 de Picciotto NE, Gano LB, Johnson LC, et al. Nicotinamide mononucleotide supplementation reverses vascular dysfunction and oxidative stress with aging in mice. Aging Cell 2016; 15(3): 522-530. doi:10.1111/acel.12461
23 Meng YF, Pu Q, Dai SY, Ma Q, Li X, Zhu W. Nicotinamide Mononucleotide Alleviates Hyperosmolarity-Induced IL-17a Secretion and Macrophage Activation in Corneal Epithelial Cells/Macrophage Co-Culture System. J Inflamm Res. 2021; 14: 479-493. doi:10.2147/JIR.S292764
24 Xie X, Yu C, Zhou J, et al. Nicotinamide mononucleotide ameliorates the depression-like behaviors and is associated with attenuating the disruption of mitochondrial bioenergetics in depressed mice. J Affect Disord. 2020; 263: 166-174. doi: 10.1016/j.jad.2019.11.147.
25 Assiri MA, Ali HR, Marentette JO, et al. Investigating RNA expression profiles altered by nicotinamide mononucleotide therapy in a chronic model of alcoholic liver disease. Hum Genomics 2019;13(1):65. doi:10.1186/s40246-019-0251-1
26 Radenkovic D, Reason, Verdin E. Clinical Evidence for Targeting NAD Therapeutically. Pharmaceuticals (Basel) 2020;13(9):247. doi:10.3390/ph13090247
27 Tsubota K. The first human clinical study for NMN has started in Japan. NPJ Aging Mech Dis. 2016; 2:16021. Published 2016 Oct 27. doi:10.1038/npjamd.2016.21
28 Irie J, Inagaki E, Fujita M, et al. Effect of oral administration of nicotinamide mononucleotide on clinical parameters and nicotinamide metabolite levels in healthy Japanese men. Endocr J. 2020; 67(2): 153-160. doi: 10.1507/endocrj.EJ19-0313.
29 Yoshino M, Yoshino J, Kayser BD, et al. Nicotinamide mononucleotide increases muscle insulin sensitivity in prediabetic women. Science. 2021;372(6547):1224-1229. doi:10.1126/science.abe9985.
30 Liao B, Zhao Y, Wang D, Zhang X, Hao X, Hu M. Nicotinamide mononucleotide supplementation enhances aerobic capacity in amateur runners: a randomized, double-blind study. J Int Soc Sports Nutr. 2021; 18(1): 54. Published 2021 Jul 8. doi:10.1186/s12970-021-00442-4.
31 Igarashi M, Miura M, Nakagawa-Nagahama Y, et al. Chronic nicotinamide mononucleotide supplementation elevates blood nicotinamide adenine dinucleotide levels and alters muscle motility in healthy old men, 09 June 2021, PREPRINT (Version 1) available at Research Square [https://doi.org/10.21203/rs.3.rs-455083/v1]
32 Kim M, Seol J, Sato T, Fukamizu Y, Sakurai T, Okura T. Effect of 12-Week Intake of Nicotinamide Mononucleotide on Sleep Quality, Fatigue, and Physical Performance in Older Japanese Adults: A Randomized, Double-Blind Placebo-Controlled Study. Nutrients 2022;14(4):755. doi:10.3390/nu14040755
33 Pencina K, Lavu S, Dos Santos M, et al. MIB-626, an Oral Formulation of a Microcrystalline Unique Polymorph of β-Nicotinamide Mononucleotide, Increases Circulating Nicotinamide Adenine Dinucleotide and its Metabolome in Middle-aged and Older Adults [published online ahead of print, 2022 Feb 19]. J Gerontol A Biol Sci Med Sci. 2022;glac049. doi:10.1093/gerona/glac049
34 Enright PL. The six-minute walk test. Respir Care. 2003;48(8):783-785.
35 Lins L, Carvalho FM. SF-36 total score as a single measure of health-related quality of life: Scoping review. SAGE Open Med. 2016;4:2050312116671725. Published 2016 Oct 4. doi:10.1177/2050312116671725
36 Mamoshina P, Kochetov K, Putin E, et al. Population Specific Biomarkers of Human Aging: A Big Data Study Using South Korean, Canadian, and Eastern European Patient Populations. J Gerontol A Biol Sci Med Sci. 2018; 73(11): 1482-1490. doi:10.1093/gerona/gly005
37 Ratajczak J, Joffraud M, Trammell SA, et al. NRK1 controls nicotinamide mononucleotide and nicotinamide riboside metabolism in mammalian cells. Nat Commun. 2016; 7:13103. Published 2016 Oct 11. doi:10.1038/ncomms13103.
38 Grozio A, Mills KF, Yoshino J, et al. Slc12a8 is a nicotinamide mononucleotide transporter [published correction appears in Nat Metab. 2019 Jul;1(7):743]. Nat Metab. 2019;1(1):47-57. doi:10.1038/s42255-018-0009-4.
39 Zhavoronkov A, Li R, Ma C, Mamoshina P. Deep biomarkers of aging and longevity: from research to applications. Aging (Albany NY). 2019;11(22):10771-10780. doi:10.18632/aging.102475.